
Download the application note
空间转录组学是一个快速发展的研究领域,该领域研究旨在提供组织内单细胞 RNA 转录组的分子图谱,并保存空间信息。
基于成像的空间生物学利用落射荧光显微镜直接识别转录物并原位观察多个目标。 但当观察视野 (FOV) 被荧光目标辐射饱和(光学拥挤)并且可视化基因数量受到光衍射的限制,就会出现常见的挑战。 因此,使用这种成像方法无法可靠且唯一地鉴定每种单独的转录物。
在最近发表在《细胞》 MDPI 杂志上的一项研究中,A. Linares 博士及其合作者研究了结构照明显微镜 (SIM) 对空间转录组学实验中单基因转录物检测性能的影响。 特别是,在该研究中,作者探索了 DeepSIM 超分辨率 (SR) 系统结合低倍和高倍物镜物镜对单个扩增子斑点定位的影响。
在本应用说明中,我们报告了一些示例,说明相较于宽场 (WF) 和共焦 (CF) 模式,CrestOptics DeepSIM SR 系统对于提高 RNA 斑点检测性能的重要性。 关于该研究的所有杰出成果的详细描述,可查看完整的论文。
SIM 增强了对比度、分辨率并提高了斑点检测性能
作者在小鼠大脑冠状切面上进行基于杂交的原位测序 (HybISS),该测序靶向四种高表达的基因(Actb、Gapdh、Atp1a3 和 Slc17a7)。 此外,为增加每个通道的斑点密度,仅使用两个通道来观察所有四个基因。
作为标准参考方法,使用 WF(图 1,左图)和 25 倍硅油浸没平场复消色差物镜 (1.05 NA) 观察样品。 然后,使用 SIM 分析了相同的 FOV(图 1,右图)。 比较获得图像后发现,在 WF 模式下成像的衍射极限斑点非常模糊且对比度不良,并且作为单个物体并非清晰可见(图 1,左图)。 另一方面,DeepSIM 产生的单个斑点具有增强的对比度和分辨率(图 1,右图)。
由于研究已证明去卷积可以改善原位测序实验的图像处理过程中的斑点检测,因此将通过 SIM 提供的图像质量改善与将去卷积应用于 WF 图像时得到的改善进行了比较。 如图 1 所示,尽管对 WF 图像进行去卷积增强了图像对比度,并产生了去模糊效果(图 1,中间图),但与 SIM 相比,分辨率提高仍有限。

图 1:WF(左图)、去卷积(中间图)与 SIM(右图)之间的斑点分辨率比较。 用 DAPI 对样品进行染色以观察细胞核,用 Cy3(Actb 和 Gapdh)和 Cy5(Atp1a3 和 Slc17a7)对样品进行染色以用于基因转录物检测。 下行中的图像对应于上行中的图像框-比例尺: 20 um(上)和2 um(下)。
图 2 显示了用 WF 或 SIM 采集的相同 FOV 的斑点量化。 DeepSIM 能够以不同方式提高斑点检测性能:
-与 WF 相比,SIM 能够检测到更多斑点。
-SIM 图像采集中的大多数斑点在 WF 图像中的强度较低。
-SIM 能够挽救低强度点信号(图 2A,白色箭头),这些信号在 WF 模式下不可见,甚至与背景混淆。
斑点量化(图 2B)结果显示,由于 DeepSIM 可提高对比度和分辨率,因此 SIM 可识别更高比例的亮暗 RNA 斑点。 对此,SIM 采集中出现了一组新暗点(图 2B 中最左图的粉色条),这对应于 WF 图像中未检测到的斑点的微弱信号(图 2A 中的白色箭头)。 此外,由于 DeepSIM 对近距离信号的分辨能力,SIM 能够对荧光团进行去噪并检测多个斑点。 总体而言,SIM 的使用将检测到的斑点数量增加了约 40%。
此外,对于转录物密度增加的特定 FOV,作者还用 SIM 或去卷积对在 WF 模式检测到的斑点数量进行了量化(图 2C)。 在图像分析管道中使用去卷积作为预处理步骤改善了斑点检测;但与使用 WF 检测到的斑点相比,仅 SIM 显示出检测到两倍多的斑点。
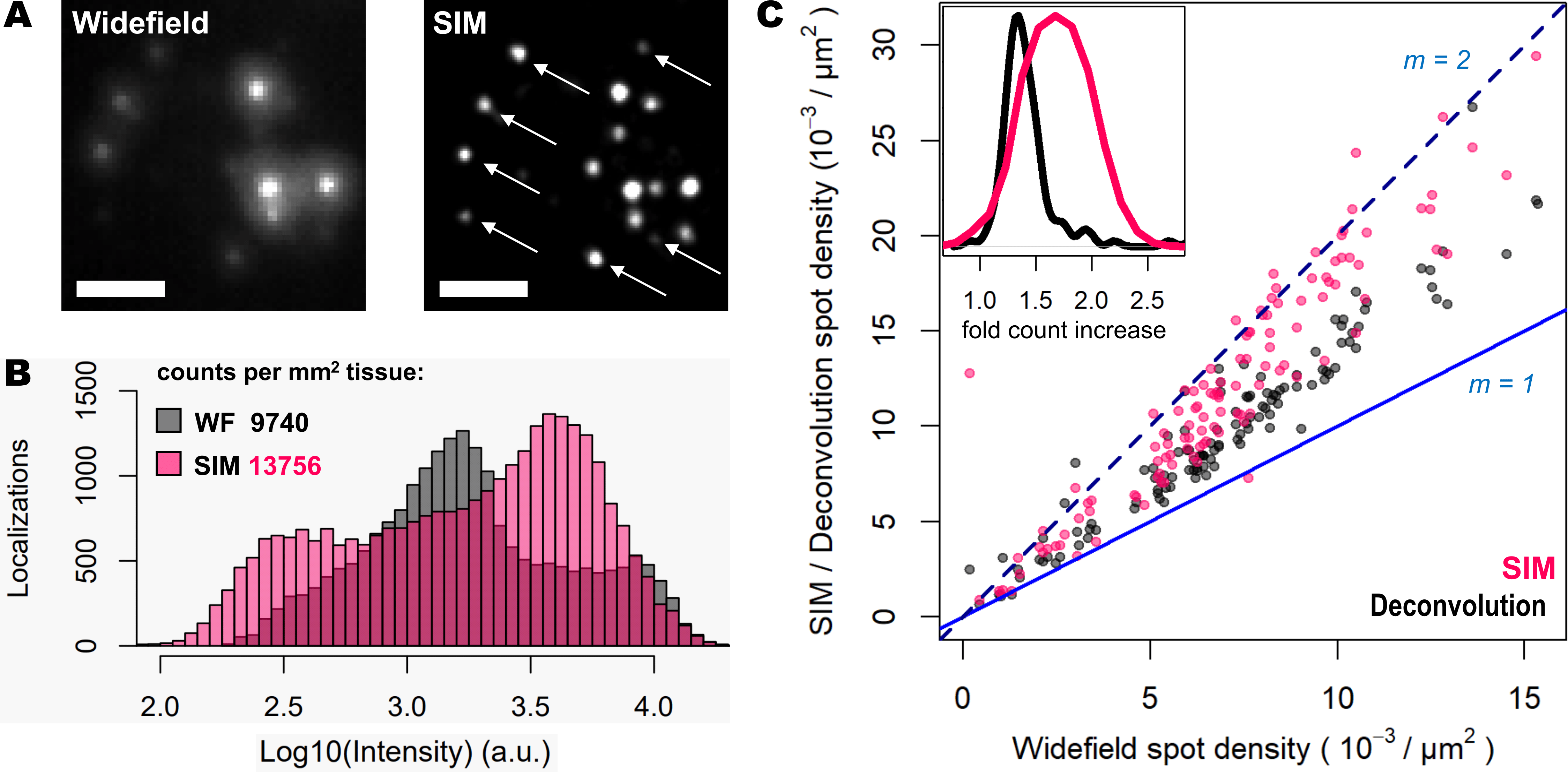
图 2: SIM 提高了斑点检测性能,并改善了斑点量化。 (A) 单个转录物的 WF 和 SIM 比较;白色箭头表示先前未检测到的超分辨率斑点。 (B) 在 WF(灰色)和 SIM(粉色)模式下成像的小鼠大脑组织中的斑点定位计数分布。 (C)该图显示了在比较 WF 与去卷积(灰色点)和 SIM(粉色点)时分析的每个 FOV 的定位计数比率。 蓝色和蓝色虚线分别对应于 1 和 2 的定位比率。内图显示了去卷积(黑色曲线)和 SIM(粉色曲线)的倍数增加分布。比例尺:5 um。
这些结果综合表明,DeepSIM 与 25 倍硅油浸没物镜的结合使用增强了对比度并提高了分辨率,使扩增的单个 mRNA 转录物的斑点检测增加了两倍。
SIM 提高了高度聚集区域中的斑点检测性能
由于 SIM 产生的影响对于更高密度而言更为明显,因此 Linares 等人测试了更密集区域的 SIM 影响。 为增加点密度,其使用了在六个成像周期中 275 个编码基因组,因此对于任何给定周期,每个通道约可以观察到 50 个基因。 每个通道具有特定的斑点光密度(图 3C),其分别将 Cy3、Cy5 和 Cy7 的分组基因称为 x 组、y 组和 z 组。 在该实验中,作者使用了 20 倍空气物镜 (0.8 NA),这是此类实验中最常用的物镜。
如图 3 所示,使用 DeepSIM 提高了对比度,降低了背景并提高了分辨率,与使用 25 倍物镜观察到的结果相似。 特别是,WF 模式下的图像显示出模糊且分辨不清的斑点。 去卷积的使用提高了分辨率和斑点检测;但 DeepSIM 提供的改善最大,并且随着点密度的增加,效果更加明显(图 3C)。 这些数据表明,SIM 的使用提高了成像荧光物体的分辨率和整体质量,从而使斑点检测更加准确和可靠。
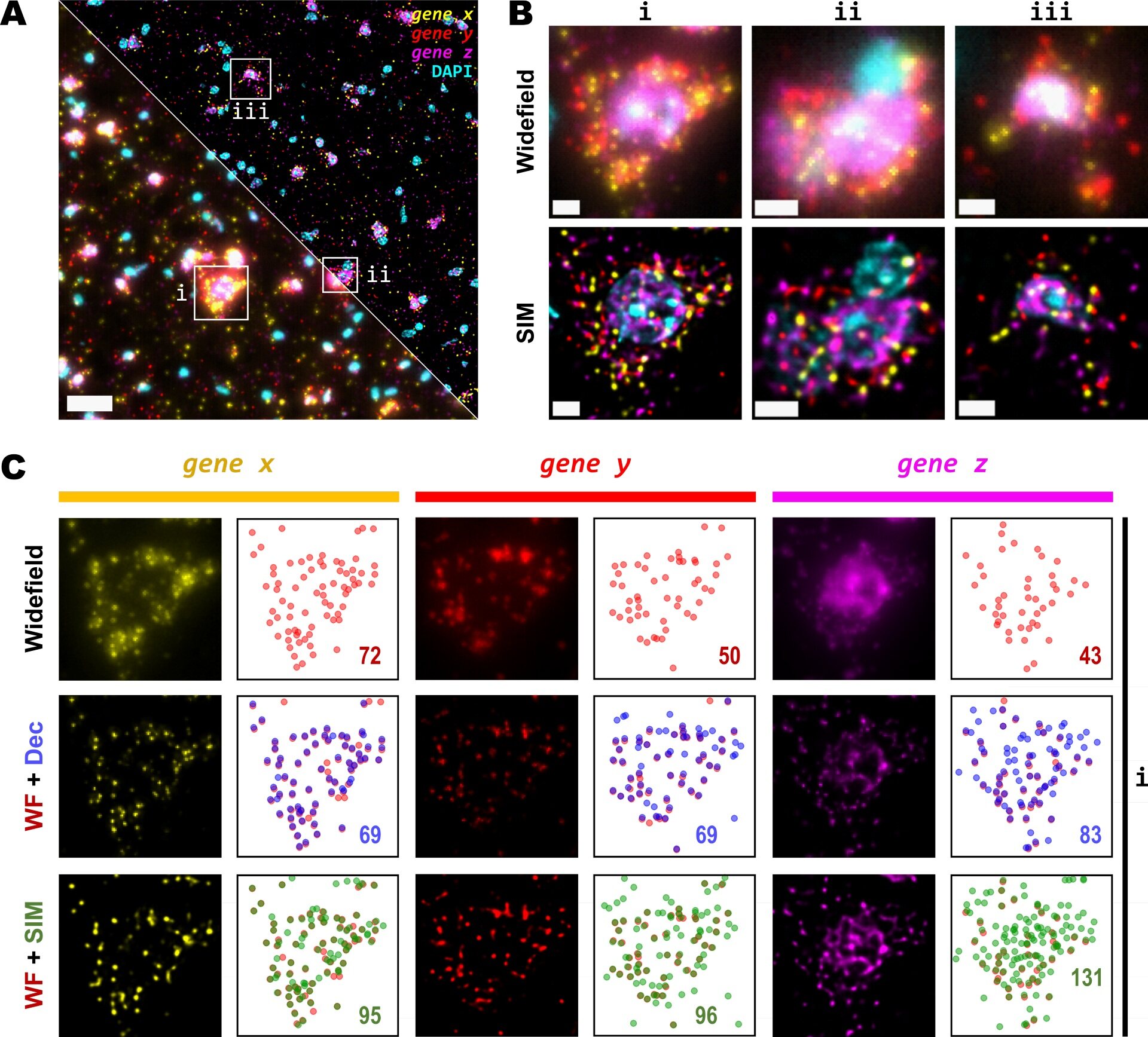
图 3: 在中等放大倍数和 NA 的超分辨图像中,RNA 斑点检测的灵敏度增加。 (A) 小鼠大脑冠状切面的单 FOV。(A)小鼠脑冠状切面的单个 FOV。 在每个通道中观察到三组 50 个基因(Cy3、Cy5 和 Cy7)。 左下角和右上角分别对应 WF 和 SIM 图像。 (B) WF(上行)和 SIM(下行)的 (A) 中的方框区域缩放视图。 (C) WF、去卷积与 SIM 图像之间每个基因通道的分辨率和对比度增加比较。 每个荧光图像旁的图显示了 WF(上行,红色)、去卷积(中间行,蓝色)和 SIM(下行,绿色)所有检测到的斑点的位置,数字表示每个通道(x 组、y 组和 z 组)的总斑点检测。 比例尺: (A) = 30 um;(B) = 5 um.。
此外,作者还研究了中低密度区域以及这些集群内的斑点检测性能(图 4A,B)。 如图 4A 和 B 所示,随着点密度的增加,SIM 的影响甚至更加明显。 斑点检测的详细检查(作为密度函数)表明,与 WF 相比,使用 SIM 可恢复更多斑点数量(图 4C)。 但在中低密度时,与低倍(20 倍)使用去卷积相比,SIM 的使用并未显示出显著差异。 与 WF 相比,SIM 图像的斑点检测从高密度和聚集区域恢复的斑点几乎是 WF 的四倍(图 4B,C),与 WF 加去卷积相比,恢复的斑点约为 WF 加去卷积的两倍(图 4C)。
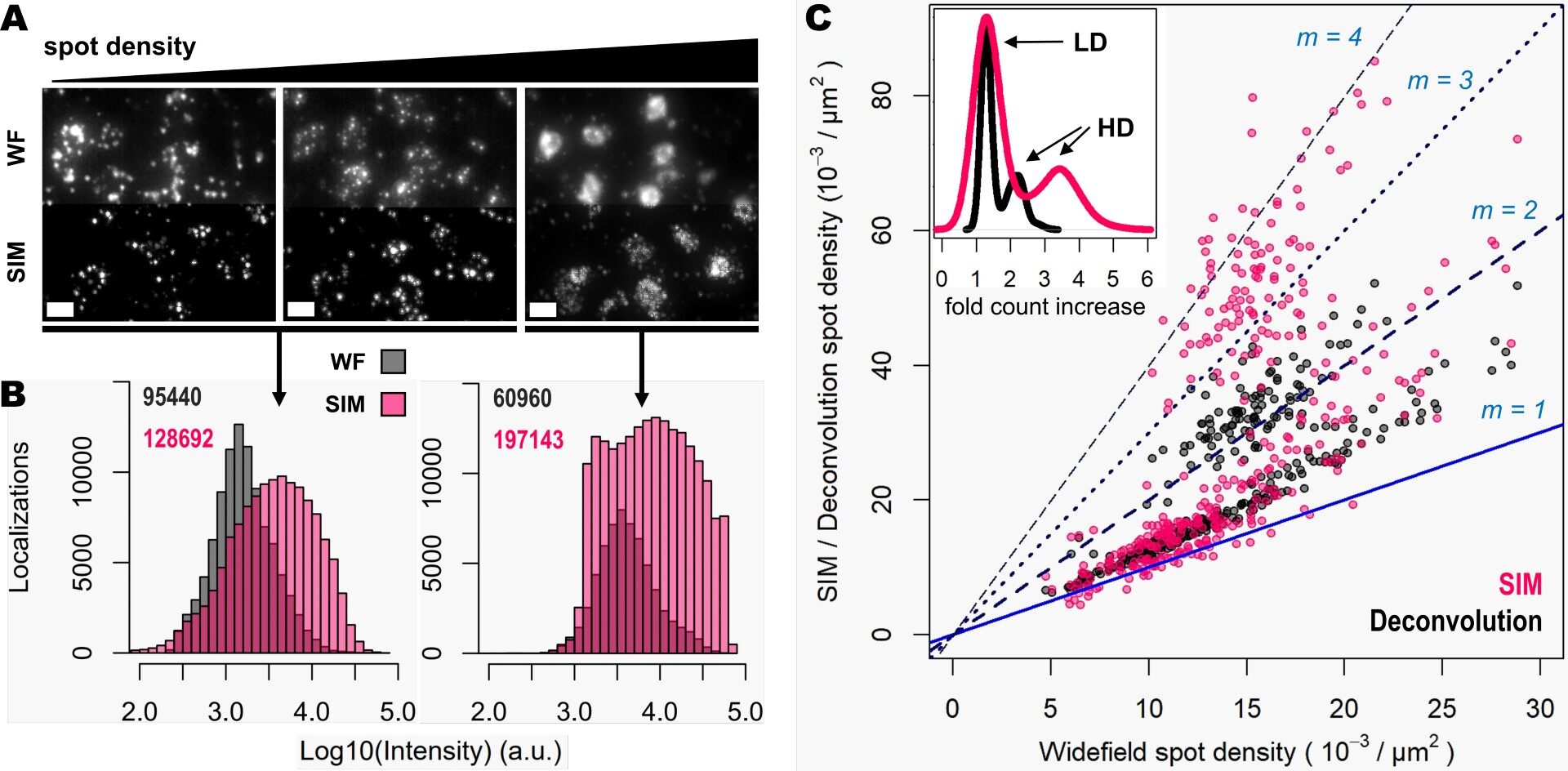
图 4: DeepSIM 改善了对高度聚集转录物的检测性能。 (A) 显示了具有增加密度的三个不同组的 50 个基因(WF,上行;SIM,下行)。 (B) 在 WF(灰色)和 SIM(粉色)中得到的图像斑点定位计数分布。 左侧直方图对应于相对低表达基因的定位计数;右侧直方图对应于具有拥挤区域的高表达基因的定位计数。 显示了每种情况下的局部斑点总数。 (C) 显示在比较 WF 与去卷积(灰色点)和 SIM(粉色点)成像模式时,斑点检测密度比率的图。 蓝色和蓝色虚线对应于从 1 到 4 增加的点密度比率。 内图显示了去卷积(黑色曲线)和 SIM(粉色曲线)的倍数增加分布。 用黑色箭头表示对应于低密度 (LD) 和高密度 (HD) 基因转录物的计数增加分布。 比例尺:10 um。
这些数据表明,当使用传统的 20 倍空气物镜成像时,使用 DeepSIM 显著有利于高密度和扩增的单个 RNA 转录物簇的斑点检测。
结论
在这项研究中,A. Linares 及其同事首次研究了 SIM 对空间转录组学实验中单基因转录物检测性能的影响。 作者对小鼠冠状脑组织切面中的多个基因进行了直接 mRNA 靶向 HybISS,并评估了 WF 和共焦 (CF) 图像中的斑点检测性能(数据未显示,请参考完整论文)与 SIM 结合 20 倍、25 倍和 60 倍(数据未显示,请参考完整论文)物镜的斑点检测性能。
为能够在不同的成像模式(WF、CF 和 SIM)之间轻松切换,作者使用了一台配有 X-Light V3 CF 转盘和 DeepSIM X-light SR 系统的显微镜,以便在一台装置中执行三种成像模式。
总的来说,SIM 模块提供的 SR 具有良好的性能,可以在空间转录组学实验中准确可靠地检测靶向转录物。 无论使用或未使用去卷积成像后处理,SIM 斑点检测性能均优于 WF 或 CF 成像方法,并且这种改善在具有高密度荧光斑点的样品区域中更加明显。
在 ISS 多重实验中,转录物鉴定依赖于单个荧光点的正确定位;在这种情况下,对于信号解码和转录物鉴定,SIM 能够增加定位精度。
通过查看大量基因,可以发现转录物密度最高的区域,从该意义上说,DeepSIM 具有提高 ISS 实验中基因表达测量动态范围的潜在能力。
总体而言,与 WF 和 CF 模式相比,SIM 提高了基因转录点的检测效率,尤其是在高度拥挤区域。 DeepSIM 能够将低倍物镜(如 20 倍或 25 倍)的性能提高一倍,从而使该系统成为空间转录组学研究的绝佳候选系统。
方法
本应用说明中介绍的所有成果均为使用 CrestOptics X-Light V3 转盘和 DeepSIM X-Light SR 系统演示得来。
如欲了解更多关于 CrestOptics 产品的信息,请访问我们的产品页面。
根据实验结果,使用了 405、477、546、638 和 749 nm 的激光激发,并在各通道中采集图像。 使用了适用于 DAPI、GFP、Cy3、Cy5 和 Cy7 的适当滤波器。
使用 0.8 NA CFI 平场复消色差 λ D 20 倍空气物镜 (Nikon) 和 1.05 NA CFI 平场 Apo λ S 25 倍硅油物镜 (Nikon) 采集堆叠图像,z 步长分别为 1 um 和 0.5 um。
致谢
本应用说明中的数据由 A.H. 博士提供。 Crevenna 和 A.Linares 博士的文章发表于 Linares 等人,2023 中,并经作者批准后重新使用。 本文中间图像的重复使用是根据知识共享署名 (CC BY 4.0) 许可协议的条款和条件进行的。
要更完整地了解这项工作所获得的所有辉煌成果,请参阅完整论文。
感谢 A.H. 博士。 感谢 Crevenna 和 A. Linares 博士对本应用说明撰写提供的支持。







