技术说明
简介
显微镜的基本用途目的是在亚细胞层面上观察和分析生物过程和结构。 然而,可观察到的最小结构大小是由光衍射极限决定,这意味着显微镜无法分辨出 200 nm 以下的结构详情。 克服这一障碍仍是现代超分辨率显微镜研究的一个活跃主题,但由于其成本和复杂性,超分辨率装置通常不是所有研究实验室的常用工具。 在 CrestOptics,我们相信,所有科学家都应可以使用超分辨率显微镜数据来推进他们的研究。这就是我们开发 DeepSIM 的原因,一款基于晶格多点结构光学的超分辨率模块。
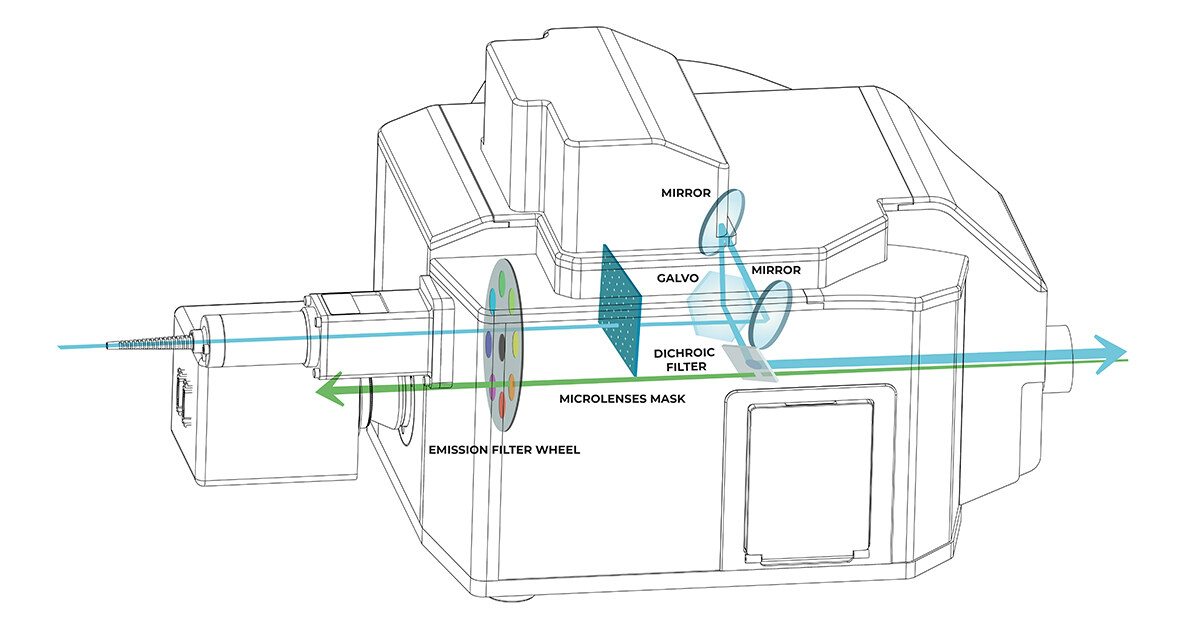
DeepSIM 模块与带有摄像头端口的正置和倒置显微镜兼容。 由于其高可及性和极度鲁棒性,DeepSIM 为每个实验室提供了将超分辨率数据采集集成为日常成像渠道一部分的可能性。 DeepSIM 超分辨率模块既可集成为独立仪器(图 1),亦可与 X-Light V3 旋转盘式装置结合使用,从而确保从宽场到共聚焦以及从共聚焦到超分辨率的无缝演变。

图 1)独立 DeepSIM 示意图。 激光(青色线)通过多模光纤进入并穿过微透镜阵列;光通过掩模针孔聚焦,晶格图案通过电动振镜投射到样本上。 样品的发射光(绿线)经过分色镜、发射滤光轮,选定的发射频率由摄像头进行检测。有关 DeepSIM X-Light 结构与 X-Light V3 旋转盘的结合使用,请参考技术说明“简易进行活细胞成像”。
由于光剂量和所需的样本制备技术,通常用于超分辨率的几种技术均不适用于活细胞成像。 DeepSIM 可以捕获超过 100 Hz 的原始图像,允许结合高度光学切片和低光毒性来跟踪生命现象。这使 DeepSIM 能够在使用传统荧光染料和分子的同时,生成深入固定和活体生物样本的超分辨率图像。 这为在细胞和厚组织内观察亚衍射受限过程和结构提供了可能性,这在以前用常规显微镜去观察相同样本制备是无法实现的。
DeepSIM 工作原理:光学
传统 SIM 是由 Mats Gustafsson 发明(参考文献 1),依赖于由应用于未知样本的线(栅格)构成的已知周期性光图案,并且通过栅格与样本之间的干涉,揭示了新的附加空间信息。 CrestOptics DeepSIM 克服了 Gustafsson SIM 的限制,例如因信号对比度差而导致样本深入观察受限以及因扫描速度慢而导致的不适合跟踪快速实时过程。 在 DeepSIM 中,光由微透镜产生的光点衍射受限晶格(即多点晶格 SIM)制成的掩模构成。 通过掩模,光图案被投射到样本上,通过振镜反射镜将掩模移动到精确角度,从而获的完整扫描的样本并采集多个原始图像。 通过算法收集和组合原始图像,以通过计算重建超分辨率图像,实现光学系统能够实现的双倍空间分辨率(图 2)。
由于 CrestOptics 必须具备灵活性,因此在 DeepSIM 系统中,有三种多点晶格图案(即三种不同的微透镜阵列)可用于满足广泛的应用。 与晶格设计相关的三种不同采集解决方案将在下面的“生物应用”段落中探讨。
总的来说,DeepSIM 结构光由微透镜阵列产生,能够实现最佳光通量、均匀光强和最佳离焦光反射。 与其他基于条纹图案的 SIM 方法相比,DeepSIM 能够确保深度采集的高对比度,大幅提升图像采集速度和稳健细化,最终确保获得最佳光学切片。
多点晶格图案

在样本上投射多点衍射受限光图案
样本扫描

扫描样本上的图案,并采集每个图案位置的原始图像
重建成像
应用算法重建和超分辨率处理图像
图 2)使用 DeepSIM 进行采集步骤和数据处理以生成超分辨率图像的概述。
DeepSIM 工作原理:计算
获得超分辨率图像的最后一步是对采集原始图像应用重建算法。 计算是基于光学系统的点扩散函数 (PSF),类似于去卷积过程。 由于 PSF 较小且光学切片良好,DeepSIM 的横向和轴向分辨率总体提高了 2 倍。 简化后,该算法提取了对焦生物信息,减去离焦信号部分。 DeepSIM 方法是联合 Richardson-Lucy (jRL) 去卷积的修改版本,并且应用于多点 SIM 能够使分辨率相对于宽场提高 2 倍(参考文献:2 和 3,图 3)
宽场
离焦
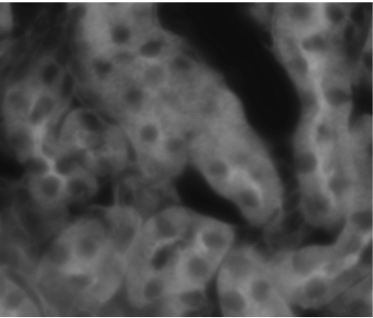
对焦
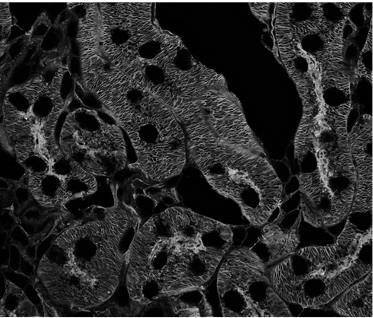
图 3)由对焦和离焦信息、通过模型计算得出的离焦信号以及计算后获得的对焦乘积结果构成的宽场数据图像示例。
与传统 Richardson-Lucy 去卷积方法一样,图像重建是通过极大似然估计 (MLE) 法实现,这是一种统计方法,从原始图像开始,通过迭代法(该方法趋于在算术上最小化统计参数)输出超分辨率图像。 在计算数学中,迭代法是一种数学过程,它使用一个初始值为一类问题生成一系列改进的近似解,其中第 n 个近似解是从前面的近似解得出(图 4)。 事实上,通常需要的迭代次数约为 25 次,并且是自动设置。 但无论如何,操作员可以通过带有“高级模式”选项的软件修改该值。 值得注意的是,高度并行运行的 CUDA 代码用于快速细化。 总的来说,DeepSIM 计算方法是一种特殊的解决方案,这与 Gustafsson SIM 的图像重建不同。
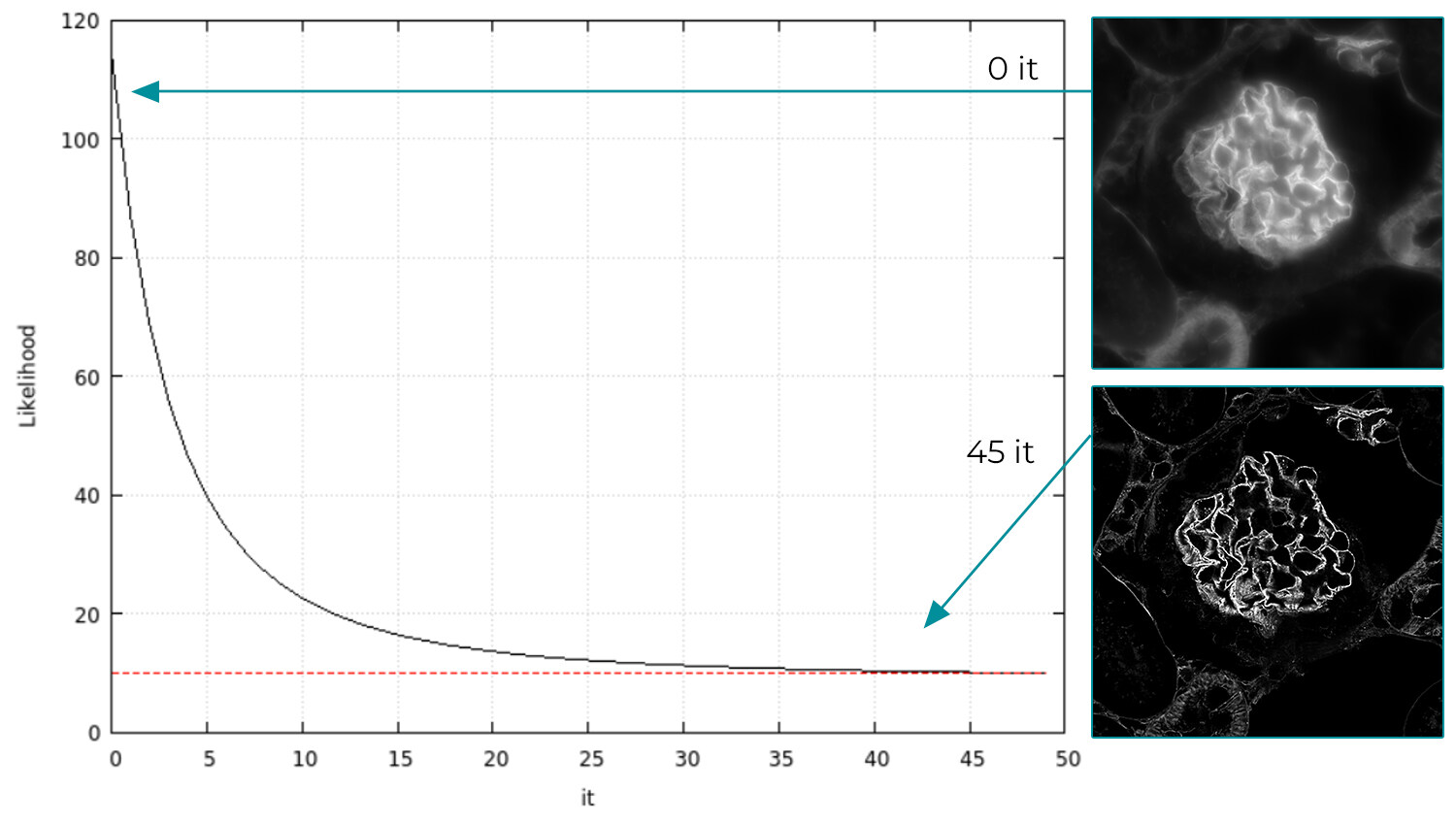
图 4)jRL 算法需要成图过程的数学模型和精确的光结构知识,以将大量单个原始数据文件迭代组合成最终超分辨率图像。 当在存在泊松噪声(光子散粒噪声)和高斯噪声(相机读出噪声)的情况下成像时,其能够最大化估计的超分辨率图像成为原始图像来源的可能性(Y 轴)。 根据贝叶斯定理,高分辨率 SIM 图像最大化了估计值 X 是采集数据来源的概率。 迭代的每一步均提供了估计值 X 的更新值,该更新值是更接近原始采集数据的近似值。
DeepSIM 是一种结合样本光照射方式和计算超分辨率数据获取方式的方法,可以改善图像光学切片,从而提高所有 3D 维度的分辨率(XY 横向分辨率: 约 100 nm;z 轴分辨率: ~300 nm)。 XYZ 轴方向的分辨率测量(即半峰全宽 (FWHM) 值)是采用不同工具完成: Argolight SIM 切片、Gattaquant SIM-Nanorules、细胞骨架等生物结构以及 TermoFisher Tetraspeck 荧光珠。技术详情请参见图 5。
A
B
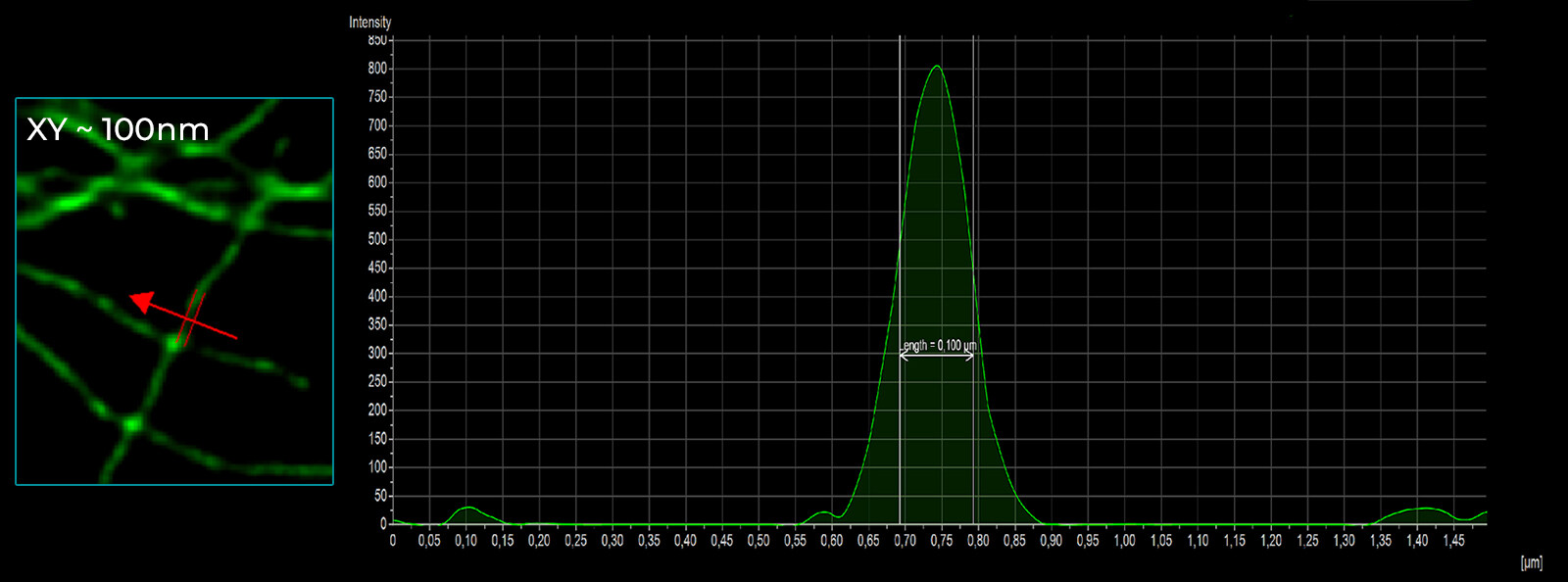
C
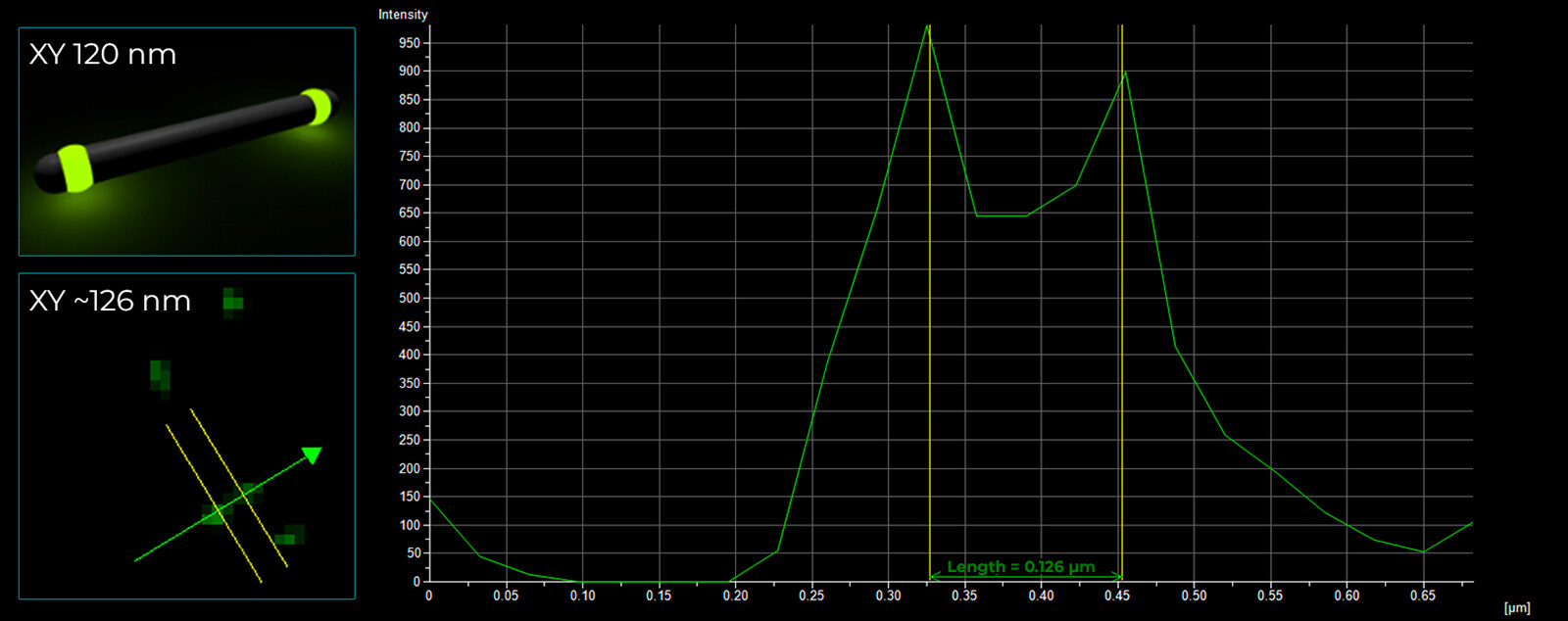
D
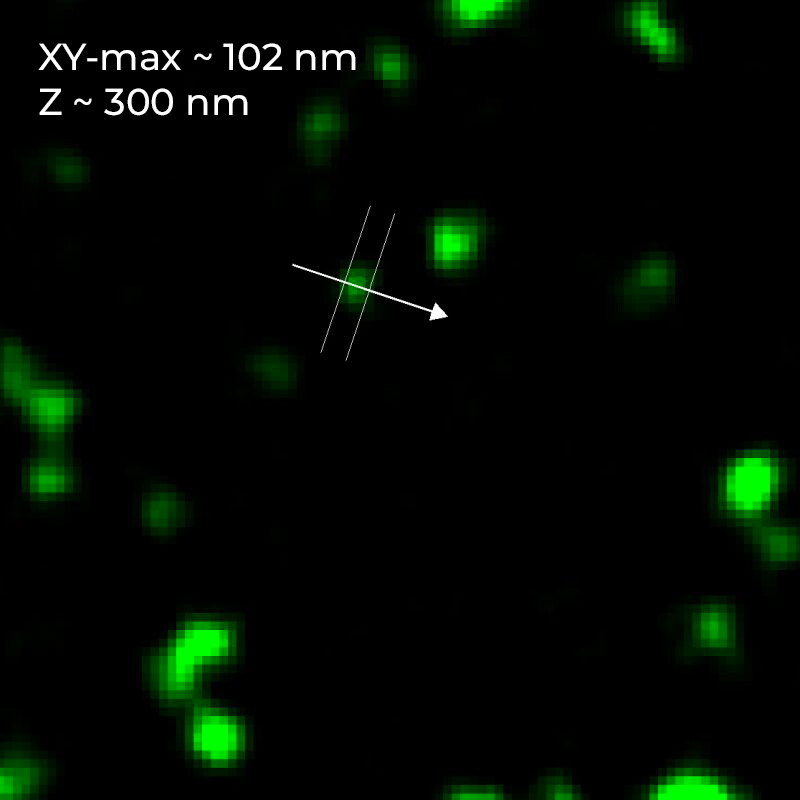
| FWHM |
荧光珠尺寸 |
|
XY-最小值 |
80 nm +/- 3.3 nm |
|
XY-最大值 |
102 nm +/- 3.3 nm |
| Z | 290 nm +/- 11 nm |
图 5) FWHM 测量。 A) Argolight SIM 切片图案,其中条形逐渐分离。 图中显示了分辨距离,数值以 nm 为单位。 B) 120 nm SIM-Nanorules。 DeepSIM 的 XY 平面大小为 126 nm。 C) 小胶质细胞中的微管蛋白(细胞骨架): XY 平面大小为 100 nm。 D) 100 nm 荧光珠: XY 平面分辨率为 102 nm,Z 轴方向分辨率为 290 nm。 所有测量均在 510 nm 发射波长下用 100 倍 1.45 NA 平面复消色差油物镜进行。
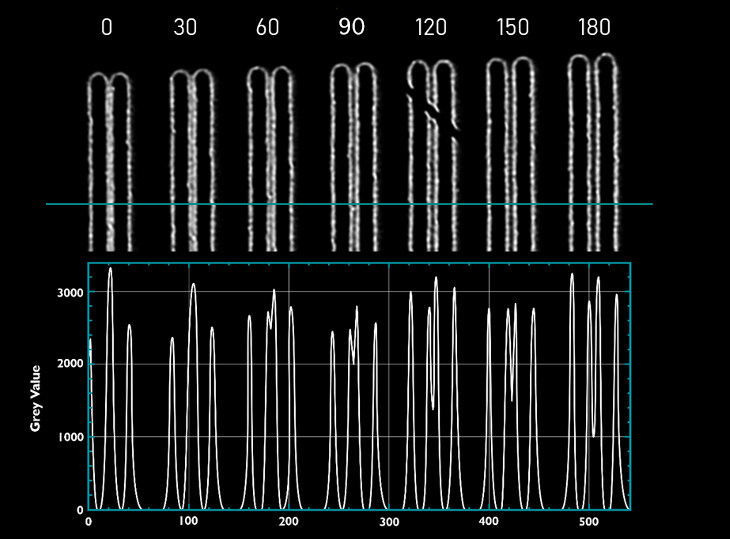
DeepSIM 重建算法保留了线性度。 通过曝光时间的线性增加测试对焦信息行为,并且测量的信号强度增加(即利用相同的重建参数(如交互次数)获得的对焦信息)与用于获得原始图像的曝光时间成线性关系(例如,使曝光时间加倍,可在最终图像中观察到双倍计数;图 6)

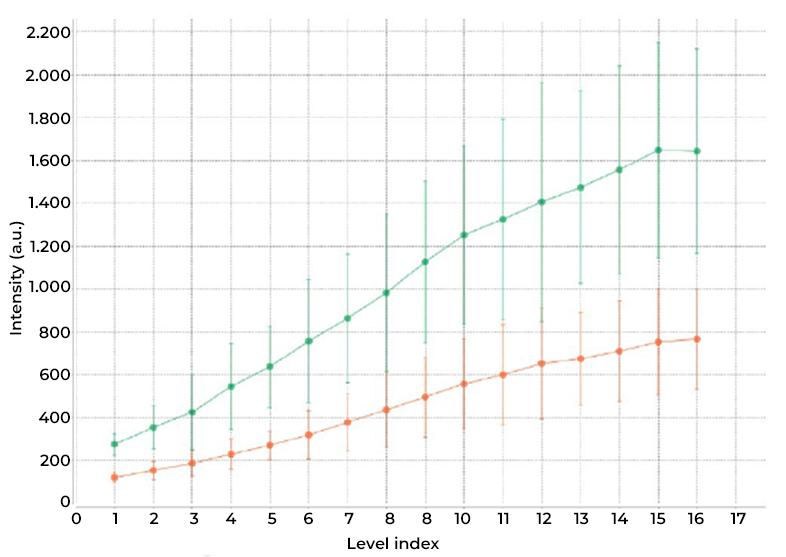
图 6)沿 16 条条纹测量强度(Argolight SIM 切片图案:具有渐进强度的条形)。 通过使曝光时间加倍(绿线: 500 ms;橙线: 250 ms),在最终图像中获得双倍计数(Y 轴,强度)。
DeepSIM:生物应用
超分辨率显微镜可以以前所未有的精细程度来可视化亚细胞组织,但也给生物学家带来了选择最适合其特殊研究问题方法的挑战。 由于采集速度慢,超分辨率商业解决方案目前仅限于一小部分可能的应用,并且穿透深度不足会影响整个成像结果。 此外,需要光转换荧光团的超分辨率方法需要专门的样本制备。 因此,DeepSIM 代表了一种可靠、易于使用且性价比高的解决方案,可在传统的 200 nm 光衍射极限上提高成像分辨率,并在传统制备的样本上获得超分辨率数据,即使是复杂异质标本。为满足广泛应用,DeepSIM 系统配备了三个结构光掩模,这些掩模是通过优化微透镜阵列产生特定的 2D 晶格多点图案(表 1)。 这三个掩模共用相同的微透镜直径,但光点之间的间距不同。 三个 DeepSIM 掩模的横向和轴向分辨率恒定不变。
更具体来说,高通量掩模适用于细胞单层以及厚度达 50 μm 的薄组织。 每帧仅需 17 幅原始图像,这种成像选项提供了超过 10 fps 的时间分辨率,以便以低光子剂量和减少的光毒性在细胞和亚细胞水平跟踪活细胞动态。 由于组织不均匀性会引起光散射,因此很难在光穿透受限的厚样本中获得超分辨图像。 为接近日益复杂的生物结构,DeepSIM 配备了标准深度成像掩模。与高通量相比,标准深度成像掩模具有更高的微透镜间距,能够为超过 100 µm 深度的深度采集提供最佳离焦光反射和更高的对比度。 这使 DeepSIM 适用性扩展至适用于共聚焦显微镜的任何常规制备样本,包括 3D 细胞模型和厚度超过 100 m 的透明组织(图 7)。DeepSIM 与低倍镜(20 倍物镜)的兼容性可以在不影响图像质量的情况下,受益于干透镜的所有优势,例如没有浸没介质或工作距离更大。 值得注意的是,DeepSIM 系统的另一个优势是在可见光谱和高达 750 nm 的 NIR 中具有多线激光兼容性,并且允许使用广泛的荧光团选项。
“不同 DeepSIM 配置增加了现有显微镜系统的可塑性,并为研究人员提供了更大的应用灵活性,因此可将 DeepSIM 视为是一个强大的超分辨率成像平台,可使用标准样本制备并且还可能可以使用所有荧光染料和蛋白质”
|
掩模定义 |
高通量 |
标准 |
深度成像 |
|
原图像编号 |
17 | 37 | 65 |
|
多点晶格图案的图式化 |
 |
 |
 |
|
建议应用 |
活细胞成像,细胞单层/组织 (最大约 50 μm) |
活体成像,薄型样品,厚型样品 (高达约 80 μm) |
密集且均匀的结构,深层成像 (>80 μm) |
表 1. DeepSIM 配备的三种不同的微透镜掩模可用于不同的采集模式。 每个掩模所需的原始图像数量已有规定。
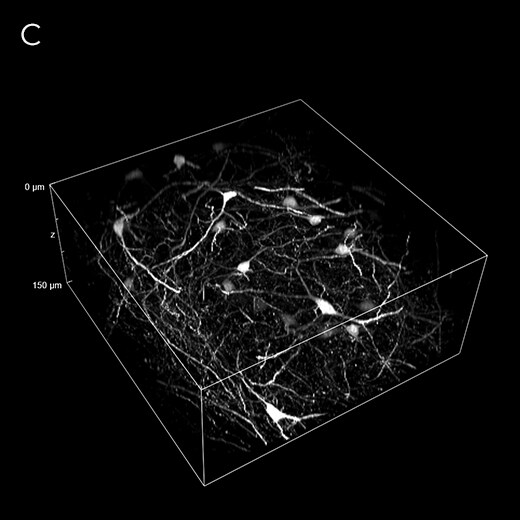
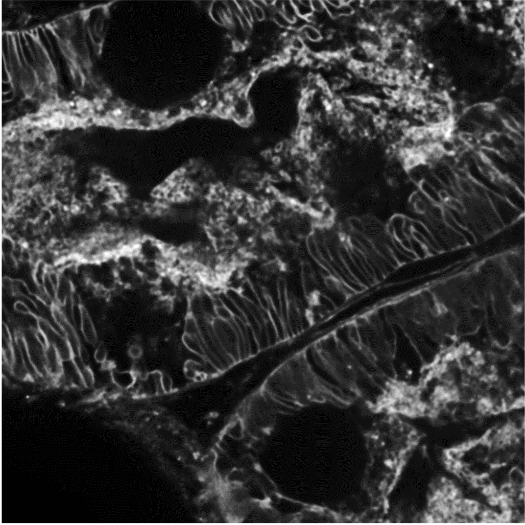
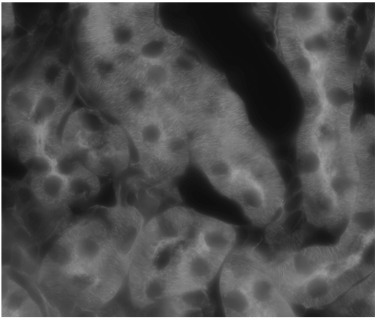
图 7A)用 SPY 505-DNA 探针 (Spirochrome),60 倍油物镜染色的 HeLa 分裂细胞的 12 小时延时成像。 图像是使用“高通量” DeepSIM 掩模获得(链接视频)。 B) 显示联会丝复合体蛋白 3 (SYCP3) 的染色体铺展,使用 100 倍油物镜和“高通量”掩模。 C) 具有 GFP 表达神经元的透明小鼠脑切片(150 μm 采集厚度),使用 20 倍干物镜和“标准”掩模。 D) 具有 GFP 表达神经元的小鼠脑切片(130 μm 采集厚度)。 60 倍油物镜。 图像是使用“深度成像”掩模获得。
请参考我们最新的 DeepSIM 应用说明,了解 CrestOptics DeepSIM 在不同生物样本、活细胞成像以及与各物镜倍率兼容方面的优势。
总结
DeepSIM 依赖于 2D 晶格多点 SIM 技术,XY 分辨率可达 100 nm,Z 分辨率可达 300 nm(100 倍 1.45 NA 平面复消色差物镜)。 三个专用微透镜掩模以及与低倍镜和高倍镜的兼容性使 DeepSIM 的应用扩展至各种生物样本,从细胞单层到 3D 细胞培养物以及厚度超过 100 m 的透明组织,其 Z 深度穿透与共聚焦显微镜相当。 DeepSIM 的光强度具有高光子效率,且时间分辨率超过 10 fps,因此非常适合在 405-750 nm 激发光谱范围内使用多种颜色和传统荧光团进行活细胞成像。
技术规格
|
独立 DeepSIM |
DeepSIM X-Light | |
|
视场 |
1024X1024 像素 (66×66 µm 100X | 333×333µm 20X) |
1024X1024 像素 (66×66 µm 100X | 333×333µm 20X) |
|
分辨率 |
横向分辨率 (FWHM):~100 nm (100X NA 1.45) 轴向分辨率 (FWHM):~300 nm (100X NA 1.45) |
横向分辨率 (FWHM):~100 nm (100X NA 1.45) 轴向分辨率 (FWHM):~300 nm (100X NA 1.45) |
|
DeepSIM 采集速度 |
13fps (1024x1024px) | 13fps (1024x1024px) |
|
激光光谱范围 |
激发:400-750 nm;发射:400-850 nm |
激发:400-750 nm;发射:400-850 nm |
|
物镜规格 |
– 20 倍到 100 倍的放大倍率范围 – 高数值孔径(不适用) – 计划复消色差校正 |
-from 20X to
– 20 倍到 100 倍的放大倍率范围 – 高数值孔径(不适用) – 计划复消色差校正 |
|
摄像头兼容性 |
任何具有 6.5 µm 像素大小的触发式摄像头 |
任何具有 6.5 µm 像素大小的触发式摄像头 |
|
多摄像头选项 |
单摄像头 |
双摄像头可用选项 * |
|
转盘升级 |
独立分辨率 |
与 CrestOptics X-Light V3 兼容的附加元件 |
|
成像模式 |
超分辨率 DeepSIM | 宽场 |
超分辨率 DeepSIM | 共聚焦旋转盘 X-light V3 | 宽场 |
|
可升级显微镜结构 |
正置和倒置结构 |
倒置结构 |
|
软件 |
µManager /VisiView® / NIS Elements |
µManager /VisiView® / NIS Elements |
|
安装条件 |
温度 23±5℃,湿度 70% RH 或更低 |
温度 23±5℃,湿度 70% RH 或更低 |
|
重量 |
50.7 lbs | 23Kg | 44 lbs | 20Kg |
|
尺寸 |
13.8(宽)x 20.2(长)x 11.4(高)英寸 352.0(宽)x 514.0(长)x 290.5(高)mm |
14.0(宽)x 17.1(长)x 11.4(高)英寸 356.0(宽)x 435.0(长)x 290.5(高)mm |
*Software integration in progress
参考文献
1) M G Gustafsson (2000),使用结构光学显微镜将横向分辨率限制提高两倍。 J Microsc, 198(Pt 2):82-7.
2) N Chakrova et al. (2016),结构光学显微镜的反卷积方法。 J Opt Soc Am A Opt Image Sci Vis, 33(7):B12-20.
3) R Heintzmann and PA Benedetti (2006),图案激发荧光显微镜中的高分辨率图像重建。Appl Opt, 45(20):5037-45.
发布日期:2022 年 11 月